1 多器官衰竭简介
多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)是指机体遭受严重创伤、休克、感染及外科大手术等急性损害24h后,同时或序贯性出现2个或2个以上的系统或器官功能障碍或衰竭,即多个器官功能改变不能维持内环境稳定的临床综合征 <sup>[1]</sup>
多器官衰竭(multiple organ failure,MOF)是MODS继续进展的最严重的终末期阶段。多器官衰竭是老年人逝世的重要原因之一,大多是70岁以上的长者。先决疾病主要包括气管、心脏、肺脏、肝脏、肾脏、脑等重要身体器官的慢性病。
多器官衰竭的特点:成因复杂病情死亡率高
- 在急性脑血管并发MOF的30例患者 <sup>[2]</sup>中,60岁及以上病死率为60%,60岁以下为26.7%
- 在某医院收录的933病毒性肝炎案例 <sup>[3]</sup>中,有18例重症肝炎并发MOF,综合死亡率为72.22%
- 1 087例MODS患者 <sup>[4]</sup>中,60岁以上所占比例达66.1%,总住院病死率为60.4%;各器官衰竭的病死率从高到低依次为心血管、脑、肾脏、胃肠、呼吸系、肝脏和凝血功能
- 创伤后 MOF 是严重创伤晚期死亡的主要原因,占此类患者所有死亡的 50-60% <sup>[5]</sup>
并发症:
- 呼吸短浅、血压急降、口唇和指甲缺氧变紫色
- 视觉神经无反应、意识朦胧、血液缺氧、休克、昏迷等
1.1 医学病理
常见病因:
- 由于感染、事故损伤、手术损伤、灌注不足以及代谢异常引起的
- 常见发展病程:因全身炎症反应综合征(SIRS)以及感染而导致败血症(脓毒症、Sepsis),之后进展到严重败血症,最后多重器官衰竭
- 需要注意的是,有三分之一的患者没有发现多重器官衰竭的主要诱因
发病机制(非绝对):
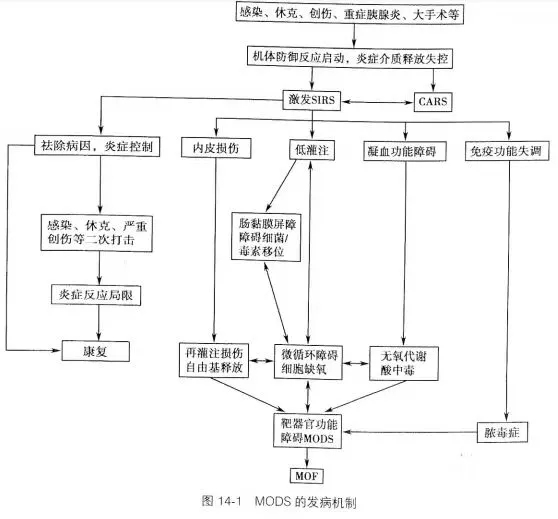
病理机制:
- 在病理生理学上,多重器官衰竭的发病机制尚未有一个确切的定义
- 器官衰竭通常被认为是组织受到损害后从而引起的局部反应和系统性反应
- 呼吸衰竭往往会在组织受到损害后的72个小时后发生,接着会有其他器官衰竭,如肝脏衰竭(5-7天),胃肠道出血(10-15天)和肾功能衰竭(11-17天)
1.2 分类分型
早期MOF与晚期MOF:
- 创伤后 MOF 通常定义为在创伤后 72 小时内发生的早期,以及发生在第三天之后的晚期。早期 MOF 被认为与创伤驱动的强烈炎症反应和免疫激活有关,而晚期 MOF 与持续炎症、免疫抑制和分解代谢综合征 (PICS) 相关
此处的早期与晚期容易混淆为对病症严重程度的描述,读者也可将早期MOF看作急性MOF,相应的晚期MOF看作慢性MOF
原发性与继发性两类
- 原发性MODS:是指严重创伤大量多次输血等明确的生理打击直接作用的结果。器官功能障碍由打击本身造成。损伤早期出现多个器官功能障碍,在原发性MODS发生病理过程中,SIRS未起主导作用。
- 继发性MODS:并非损伤直接后果,而是机体异常反应的结果,原发损伤引起SIRS{全身炎症反应综合征},而SIRS进一步导致自身破坏是器官功能损害的基础。造成远隔器官功能障碍继发性MODS与原发损伤之间有一定时间间隔,多并发脓毒症,原发性MODS如能存活,则原发损伤和器官功能损害激发和导致SIRS,加重原有受损器官或引起新的远隔器官功能障碍,使原发性MODS转变为继发性MODS。
MODS分型:根据临床特征可把 MODS分为单相速发型,双相迟发型和反复型三型
- 单相速发型是在感染或心、脑、肾等器官慢性疾病急性发作诱因下,先发生单一器官功能障碍,继之在短时间内序贯发生多个器官功能障碍。
- 双相迟发型是在单相速发型的基础上,经过一个短暂的病情恢复和相对稳定期,在短时间内再次序贯发生多个器官功能障碍。
- 反复型是在双相迟发型的基础上,反复多次发生MODS,根据不同年龄的病理生理特点,发病诱因、临床特征、治疗重点不同和预后差别,也提出了老年MODS(MOFE)和儿童MODS(MOFC)的概念和临床类型。
1.3 婴幼儿童的 MODS 诊断
2 多器官衰竭核心指标
多器官衰竭的定义
除了序贯器官衰竭评估 (SOFA) 评分,与多器官衰竭相关的核心指标还包括丹佛(Denver)MOF评分、马歇尔(Marshall)MOF评分。
三者具体定义与特性可参阅:2 器官功能衰竭评分
以上三个评分的计算量表可参考:Multiorgan failure in the serious trauma patient
3 相关论文调研与概述
3.1 多器官衰竭MOF的核心指标对比
论文标题:Which score should be used for posttraumatic multiple organ failure? - Comparison of the MODS, Denver- and SOFA- Scores<sup>[7]</sup>
针对ICU停留时间超过48小时的重伤患者分别计算SOFA评分、丹佛评分和马歇尔评分。并用于特定结果(死亡率)或资源需求量(住院时间、机械通气天数MVD、无呼吸机天数VFD)的预测。所有分数使用每日最差值,并以受创后第三天的MOF评分作为分析和预测的关键时间节点
参与观察的有176名严重外伤患者,最终有32人死亡(18.2%)。死亡原因包括多器官衰竭(28%)、呼吸衰竭(22%),脑功能衰竭(22%)和败血症(12%)
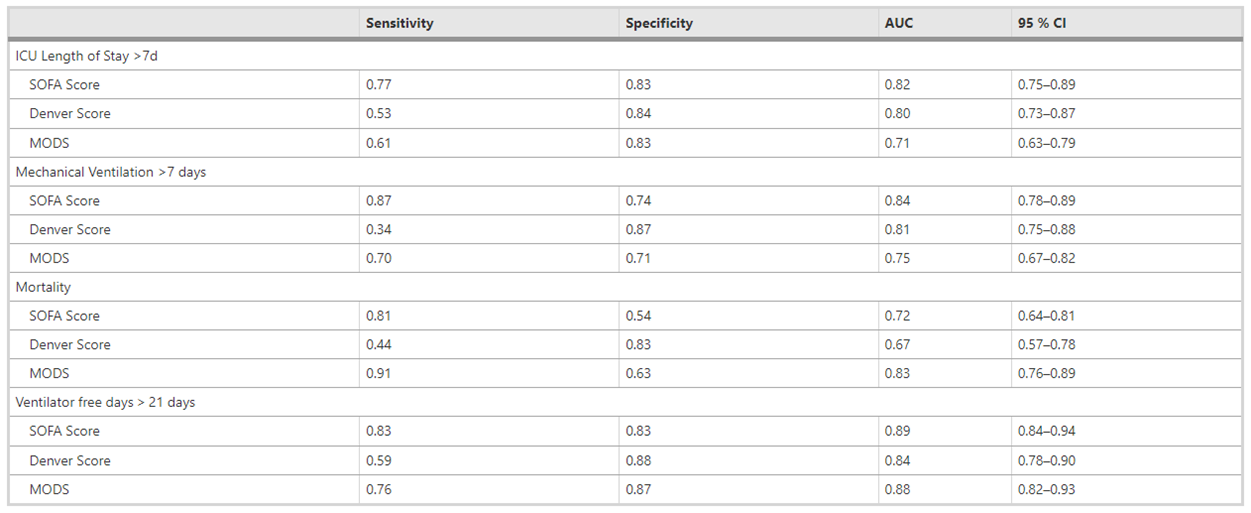
小结:丹佛评分特异性更高,而SOFA评分和马歇尔评分的灵敏度更高。综合来看,SOFA评分表现更为稳定
3.2 严重创伤患者的多器官功能衰竭
论文标题:Multiorgan failure in the serious trauma patien<sup>[8]</sup>
创伤后严重多器官衰竭的风险因子:年龄(55或65岁以上)、性别(73.1%男性)、创伤的严重程度(ISS评分)、创伤性脑损伤、血液制品(避免早期输注超过6单位的红细胞、避免输注新鲜冰冻血浆)、凝血障碍和血小板减少、血流动力学状态和乳酸、近24天最低胆红素、肌酐浓度峰值、肥胖等
创伤后严重多器官衰竭的治疗相关
- 心肺支持:以允许性低血压和纠正低体温、凝血病和酸中毒为导向。存在创伤性脑损伤时,应该注意寻求更高的动脉压水平
- 损伤控制和受感染组织清创:控制出血,避免长时间干预,以免加重酸中度和凝血功能障碍。使用真空系统和二次干预(second-step interventions)有助于减少感染并发症
- 输血和血液制品:采用更严格的方法以避免不必要的输血(存在争议)
- 其他:如保护性机械通气、充足的营养支持、用胰岛素或肾上腺替代疗法控制高血糖
补充说明:伤害严重程度ISS评分
将身体划分为六个 ISS 区域(头颈、面部、胸部、胸部、腹部或盆腔、四肢或骨盆、外部)。每个区域评分为1-6(次要、缓和、严肃、严重、致命、无法治疗),最终的ISS得分为评分最高的三个区域得分的评分和(ISS=A2+B2+C2),当最高评分为6时,ISS自动设置为75分
3.3 老年多器官衰竭的肾脏问题
论文标题:老年多器官衰竭的肾脏问题<sup>[9]</sup>
老年多器官衰竭的特点:
- 老年多器官衰竭(multiple organ failure in the elderly,MOFE)患者器官衰竭的顺序通常为肺、心、肝、肾,一旦出现肾衰竭,预后极差。
- 根据其他文献综合分析,MOFE在高危人群中的患病率为6%~7%,MOFE的病死率平均为70%,病死率随衰竭器官的数量增加而明显增加,尤其是合并ARF(急性肾衰竭)的高龄老年人,病死率可高达86.9%~90.5%
老年多器官衰竭的常见病因:MOFE的肾脏病变主要是急性肾损伤(acute kidney injury,AKI)并迅速发展为急性呼吸衰竭 ARF。老年AKI以肾前性AKI(各种原因引起的肾脏血流灌注不足所致的肾损伤)为主,约占64.3%,其次是肾毒性药物(22%)和外科手术相关AKI(14%)
老年AKI的两种特殊情况:
- “血压正常的AKI”:高血压患者的血压水平在短期内迅速下降,此时尽管血压仍处于”正常”水平,仍可发生肾脏灌注不足的问题
- “跨肾灌注压”;中心静脉压CVP较高的情况下仍可能存在肾损伤,这是因为通气、腹胀、静脉输液过多、肺动脉高压等情况引起腹腔压力增加等临床情况,引起CVP的增高而导致平均动脉压TTP下降
针对老年多器官衰竭的治疗:
- 本文建议借助减量法、延长间隔时间法控制药物剂量;
- 在血容量充足的情况下,应尽快使用升压药物,如多巴胺(不推荐,不良后果较多)或肾上腺素;血容量不足时推荐使用液体疗法
- 最常见的治疗方式还是呼吸支持(机械通气)和血液净化(难点在于血管通路的建立,尽量在尿毒症并发症出现前进行);
- 注意检查可能的肾毒性药物,检测并及时处理AKI急性并发症
补充1:AKI早期诊断的生物标志物
- 传统诊断标准主要为肌酐和尿量,但偏滞后
- 其他可进行早期诊断的指标包括血液检查方面:胱蛋白酶抑制剂胱抑素C(cystatin C,CysC)、中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL);
- 尿液检查方面:肾损伤分子-1(kidney injury molecule 1,KIM-1)、尿 N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-β-D-glucosaminidase,NAG)、NGAL、白细胞介素-18(interleukin-18,IL-18)等
- 其中CysC,NGAL和NAG检测已在AKI诊断的临床
补充2:肾损伤相关的检测指标:定期监测肾小球滤过率(glomerular filtration rate,GFR)的变化、测定尿微量白蛋白以及血CysC或尿NAG的改变。
3.4 心肾综合征的相关小结
论文标题:Cardiorenal syndrome: Multi‐organ dysfunction involving the heart, kidney and vasculature<sup>[10]</sup>
心肾综合征(CRS)是一种多器官疾病,包括心脏、肾脏和血管系统功能障碍。
心脏与肾脏存在很高的共病率 - 心血管合并症是慢性肾脏病 (CKD) 患者死亡的主要原因。 - 将近 75% 的终末期肾病 (ESRD) 患者存在左心室肥厚 (LVH),其中 40% 存在冠状动脉疾病。 - 大约 20% 的心力衰竭 (HF) 患者有中度至重度肾功能障碍,超过 60% 至少有轻度肾功能障碍。
心肾综合征(CRS)的病理生理学特征
- 神经激素和交感神经系统通路的相互作用:心输出量减少导致肾灌注不足
- 在心肾综合征中,容量超负荷和静脉充血是导致炎症的两个主要病理生理事件
- 存在氧化应激的情况:心脏问题导致的氧耗竭,会打破ROS-一氧化氮稳态,并最终导致肾损伤
- 纤维化以细胞外基质沉积的形式存在,会干扰心脏的机械功能和导电性,导致肾功能下降,被认为是心肾综合征的主要原因
- 慢性肾病中的压力超负荷会导致动脉壁肥大和壁管腔比增加;贫血是影响心肾综合征死亡率的重要因素;全身性疾病是继发性心肾综合征(5 型)的根本原因,其中最常见的病症是脓毒症(sepsis)
心肾综合征(CRS)诊断的生物标志物 -传统的心肌标志物: 白细胞增多和C反应蛋白 -传统的肾脏标志物: 血清肌酐和估计的 GFR -血尿素氮与健康人群的心力衰竭结果相关 -早期识别器官损伤及其生物标志物
心肾综合征(CRS)的治疗方式
- 利尿剂仍然是纠正容量超负荷的主要药物,尤其是在心源性心肾综合征中。考虑到利尿剂抵抗(短期耐受),CRS患者可能需要更大剂量的利尿剂
- 正性肌力药可用于治疗低血压和低心输出量,但可能会导致心律失常。
- β-肾上腺素能受体拮抗剂(阻滞剂)可能有助于改善前向血流,存在低血压和心动过缓的潜在副作用
- RAAS 抑制是治疗心力衰竭和慢性肾病的主要药物疗法之一。在解决容量不足问题后,建议从最低剂量开始使用 RAAS 抑制剂,同时避免使用非甾体类抗炎药
- 单独的心脏和肾脏移植是终末期患者的选择。涉及两个器官的双重移植很少被考虑。肾功能是心脏移植 (HTx) 术后存活的重要因素
- 姑息治疗也应贯穿整个疾病过程
3.5 创伤后多器官衰竭的风险因素
论文标题:Risk Factors Associated With Early and Late Posttraumatic Multiorgan Failure: An Analysis From RETRAUCI<sup>[11]</sup>
多器官功能障碍在本论文中的定义:两个或多个器官的SOFA评分≥3
外伤MODs相关统计:10% 的严重外伤 ICU 患者出现多器官衰竭,早期 MOF 是主要形式(占比81%)。MOF与死亡存在强相关性,患有MOF的死亡优势比为4.77 (4.22–5.40)
血液动力学考虑:
- 稳定:在初始创伤护理期间收缩压 > 90 mm Hg
- 不稳定:收缩压<90 mm Hg,需要容量置换(volume replacement)才能正常化
- 休克:收缩压 < 90 mm Hg 需要容量置换、血液制品和血管活性支持以恢复正常。
- 难治性休克:容量置换、血液制品或血管活性支持以及大量出血方案的激活难治性低血压。
- 创伤相关凝血病:凝血酶原时间延长超过对照组的1.5倍,或纤维蛋白原<150mg/dL或血小板 <100,000/μL
早期 MOF 风险:ISS ≥ 16(OR 2.80)、血流动力学不稳定(OR 从 2.03 到 43.05)、创伤相关凝血病(OR 2.32)和急性肾损伤(OR 4.10);晚期 MOF 风险:年龄 > 65 岁(OR 1.52)、血流动力学不稳定(OR 从 1.92 到 9.94)、急性肾损伤(OR 4.22)和院内感染(OR 17.23)相关。MOF 与死亡率密切相关( OR 4.77 (95% CI 4.22–5.40))
3.6 早期多器官衰竭的建模预测
论文标题:Machine learning for the detection of early immunological markers as predictors of multi-organ dysfunction<sup>[12]</sup>
数据概述:在重创后的89名患者中筛选出61名,记录患者在超早期(<=1h)、4-12h和48-72h这三个时间节点时的免疫信息,进行建模分析。其中免疫信息主要来自中性粒细胞功能分析、单核细胞对脂多糖(LPS)刺激、血液学、CFDNA分析和血清分析(细胞因子和皮质醇)
特征选择:
- 使用LASSO回归和弹性网络EN进行特征的自动化筛选
- 最终找到四个重要的预测因子:趋化肽(FMLF)处理后的CD62L表达下降、CD63表达、单核细胞频率、中性粒细胞降低
模型评价(详见下图):
- 左子图为单变量模型表现,右子图为多变量模型表现
- 最终模型的预测结果的AUC=0.874
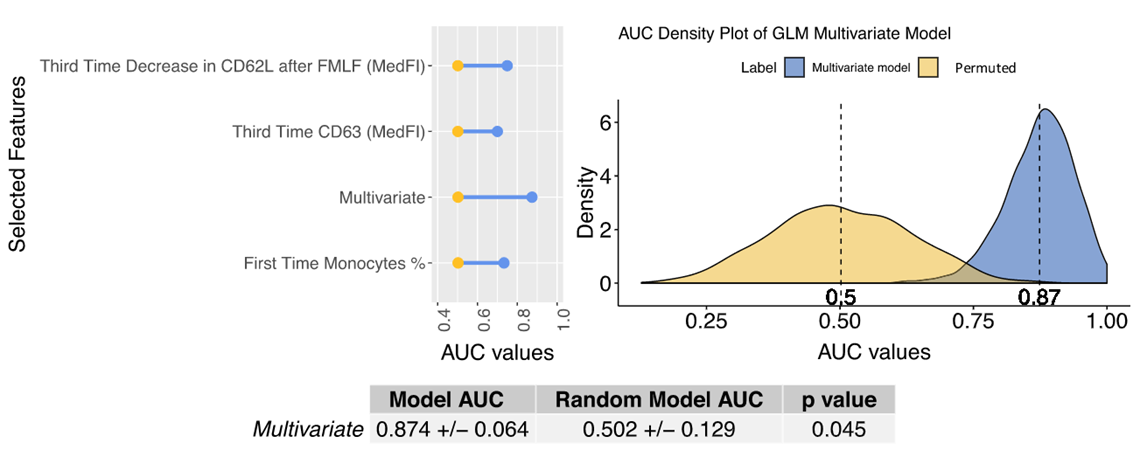
模型改进:
- 单独引入PS14生存概率,AUC可提高至0.917
- 单独引入NISS评分,AUC可提高至0.922
- 白蛋白和乳酸盐可能也对MODs早期预测很重要
补充说明:
NISS评分,基于缩写损伤量表(AIS)计算的平方之和,因此仅限于解剖学信息 PS14生存概率,考虑因素:年龄,性别,伤害严重程度(ISS),已知的医疗状况,患者结局(最多30天)和格拉斯哥昏迷(GCS)评分
3.7 预测脓毒症患者发生发生 MODS
《血清 LXA4 联合 MMP-9 预测脓毒症患者发生发生多器官功能障碍综合征的临床研究》
数据概述:
- 选择 2020 年 1 月 -2023 年 1 月期间中国人民解放军空军军医大学第二附属医院接受治疗的 140例脓毒症患者作为研究对象。根据患者入院 28 d 内是否发生 MODS 将其分为 MODS 组(n=41)和非 MODS 组(n=99)。
- 本次纳入的 140 例脓毒症患者,入院 28 d内共有 41 例发生 MODS,发生率为 29.29%(41/140)。
- MODS 组血清 LXA4 水平低于非 MODS 组,MMP-9 水平高于非 MODS组(P<0.05)
单因素分析:脓毒症患者发生 MODS 与合并高血压、脓毒症病程、存在休克、年龄、合并糖尿病、存在细菌感染、APACHEII 评分、疾病严重程度、SOFA 评分、存在低血钙、PCT 有关(P<0.05)。
多因素 Logistic 回归分析:

- 年龄偏大、MMP-9偏高、脓毒症病程偏长、LXA4 偏低、APACHE II 评分偏高、PCT 偏高、SOFA 评分偏高、存在休克、合并糖尿病、存在低血钙、合并高血压、疾病严重程度为危重、存在细菌感染均是脓毒症患者发生 MODS 的危险因素(P<0.05)
- 血清 LXA4、MMP-9单独及联合检测预测脓毒症患者发生 MODS 的曲线下面积(AUC)分别为 0.815、0.821 和 0.898,联合检测的效能优于单独检测
总结:脓毒症并发 MODS 患者血清 LXA4 下降,MMP-9 升高,二者联合检测对脓毒症并发 MODS 中具有较好的预测价值。
3.8 基于血液转录组的创伤后 MODS 生物标志物
实验设计:
- 本研究的数据来源于Glue Grant(“炎症与机体对损伤的反应”)队列,该队列涵盖了2003年至2009年间收治的创伤患者数据。从该队列中,最终筛选出了141名患者作为研究对象,其中包括58例MOF病例和83例非MOF病例
- 算法选择:采用LASSO和XGBoost两种算法进行特征选择和模型开发
数据分析:
- 与非MOF病例组相比,MOF病例组中男性的比例更高,且基线损伤严重程度评分普遍较高
- MOF病例组的感染率高达86.2%,显著高于非MOF病例组的48.2%(p<0.001)
- 大多数MOF病例在MOF发生后首次发生感染。肺炎是最常见的感染类型,其次为手术部位感染
模型性能:
- XGBoost模型表现出卓越的预测性能(训练集AUROC为0.999,测试集AUROC为0.907),显著优于LASSO模型(训练集AUROC为0.938,测试集AUROC为0.833)和基于重叠转录本的多变量逻辑回归模型(训练集AUROC为0.935,测试集AUROC为0.836)
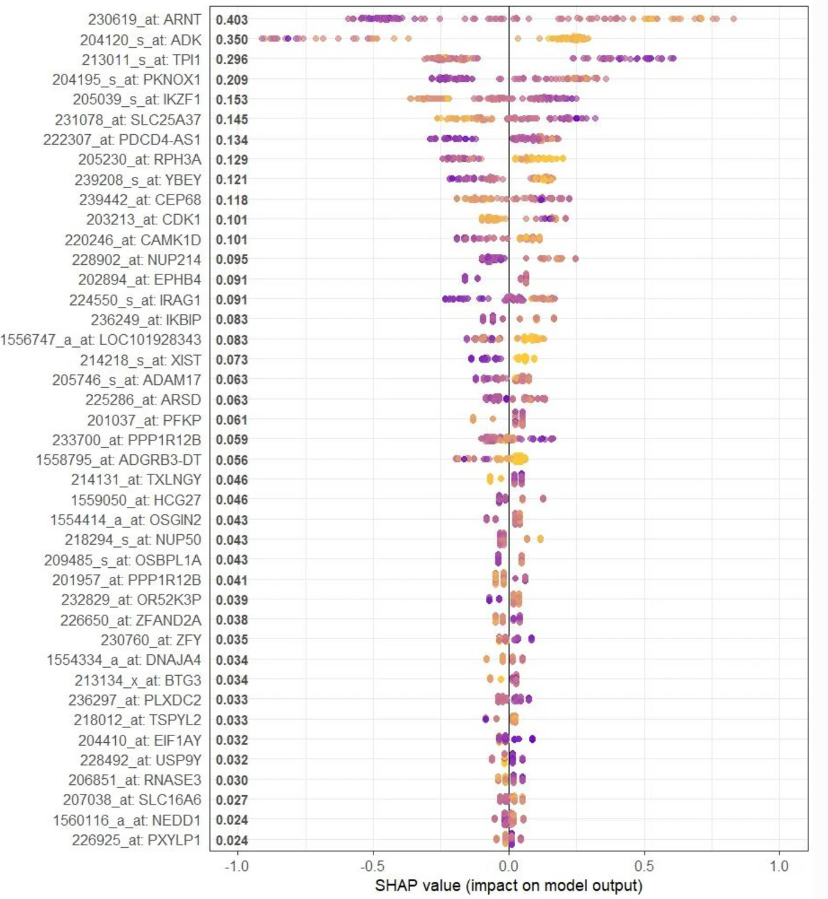
4 其他进阶调研
专家共识或指南:
参考文献
[1]. 梁建业. 多脏器功能失常综合征或多器官衰竭患者病情评分系统[J]. 中华危重病急救医学, 2000, 12(10):626-630.
[2]. 贾小霞. 急性脑血管病并发多器官衰竭30例临床分析[J]. 医学理论与实践, 2015, 28(9):2.
[3]. 张万会, 鄢立辉. 重症肝炎并发多器官衰竭的护理[J]. 中国中医急症, 2013, 22(8):1.
[5]. Multiorgan failure in the serious trauma patient
[6].“Quick SOFA” Score in Sepsis: Prediction for Outcome in Critical Care Patient
[8]. Multiorgan failure in the serious trauma patient
[9]. 程庆砾. 老年多器官衰竭的肾脏问题[J]. 中华老年多器官疾病杂志, 2014, 000(002):81-83.
[10]. Cardiorenal syndrome: Multi‐organ dysfunction involving the heart, kidney and vasculature
